Do napisania kolejnego wpisu z cyklu naukowych ciekawostek natchnął mnie egzamin, który ma się odbyć w poniedziałek i na który uczę się od kilku dni.
Na dzisiaj przewidziałem temat pozornie banalny i oczywisty. Gdyby spytać niemal kogokolwiek o to, czym jest temperatura, ciężko byłoby znaleźć kogoś, komu nie wydawałoby się, że zna odpowiedź na to pytanie. Oczywiście tylko jeśli chodzi o temperaturę rozumianą potocznie jako 'ciepłota' otoczenia albo obiektu. W rzeczywistości (i naukowo) jest jednak nieco inaczej.
Temperatura jest miarą średniej energii kinetycznej cząstek w danym układzie, czyli na przykład w powietrzu w pokoju, w którym się znajdujemy. Średniej, bo w przypadku molekuł posługujemy się danymi statystycznymi - nie jest możliwe (ani nie ma sensu) dokładne określanie parametrów pojedynczej cząstki (no, poza pewnymi badaniami naukowymi). Oznacza to mniej więcej tyle, że wszystkie cząstki wchodzące w skład powietrza poruszają się z mniejszą lub większą prędkością. Cząstki o niższej temperaturze poruszają się wolniej, niż te o wyższej.
Średnią energię kinetyczna cząstki można wyliczyć z prostego wzoru:
E=3/2kT
Jeśli przyrównamy to do wzoru na energię kinetyczną z gimnazjum (E=mv^2/2), jesteśmy w stanie bardzo łatwo obliczyć przeciętną prędkość cząstki powietrza w pomieszczeniu, w którym przebywamy. Przybliżę tutaj całe powietrze do azotu (N), z którego składa się ono w większości. Po prostych przekształceniach uzyskujemy wzór na średnią prędkość cząstki:
v=Pierwiastek(3kT/m)
Gdzie k oznacza stałą Boltzmanna, T temperaturę wyrażoną w Kelwinach (ważne! potem wytłumaczę dlaczego), a m masę cząstki.
Po obliczeniu tej średniej prędkości dla cząstki azotu w pomieszczeniu o średniej temperaturze 20 stopni Celsjusza, uzyskujemy wynik, że cząstki powietrza poruszają się średnio z prędkością... 730 m/s. Albo 203 km/h, jak kto woli. Nieźle, prawda? Pytanie brzmi jakim cudem nie czujemy tych uderzeń na swojej skórze? Cóż, odpowiedź brzmi, że jednak czujemy - poprzez ciśnienie atmosferyczne, ale to temat na inną dyskusję.

Cząstki w formie gazowej.
Kontynuujmy temat temperatury. Powiedzieliśmy już sobie, że temperatura jest miarą średniej energii kinetycznej cząstek. W związku z tym, ze spadkiem temperatury wiąże się spadek tej średniej prędkości. Więc nasze szybkie cząsteczki gazu będą poruszać się coraz wolniej... wolniej... i wolniej... aż do momentu przemiany fazowej. Tak naprawdę istnieje dużo faz pośrednich, ale skupimy się tylko na tych trzech najbardziej oczywistych: gaz, ciecz, kryształ.
No więc nasza cząstka porusza się coraz wolniej, aż zaczyna coraz silniej oddziaływać z innymi wolniejszymi cząstkami 'swojego gatunku'. W ten sposób uzyskujemy ciecz.

Panie i panowie, oto ciecz. Liczyłem, że uda mi się znaleźć coś lepszego (Jakąś animację pokazującą jak molekuły na chwilę łączą się i rozrywają), ale niestety nic takiego nie znalazłem.
Mamy więc ciecz. Obniżamy nadal temperaturę naszej substancji, cząstki poruszają się jeszcze wolniej i coraz silniej zaczynają między sobą oddziaływać, by w końcu związać się mniej lub bardziej trwale. Uzyskujemy kryształ.
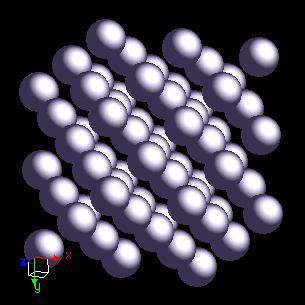
Jednak - obniżyliśmy temperaturę do pewnego momentu, mamy już ciało stałe ale nadal nie osiągnęliśmy zera absolutnego? To w końcu jak, poruszają się czy nie?
Odpowiedź brzmi: tak, poruszają - w pewnym zakresie. Mianowicie nasze wesołe cząstki oscylują i drgają na wiele sposobów. Nie jesteście sobie w stanie wyobrazić na ile różnych sposobów drgają niektóre kryształy - mogłyby zawstydzić większość uczestników tańca z gwiazdami swoimi pląsami.

Drgania trwają dalej, wraz z obniżeniem temperatury słabną coraz bardziej... aż do momentu osiągnięcia... nie. Zawsze drgają. Pewien znany fizyk powiedział kiedyś, że da się opisać całą rzeczywistość za pomocą drgań i miał rację. Drgania molekuł nigdy nie ustają. Wynika to z trzeciej zasady termodynamiki - nie da się osiągnąć zera absolutnego (które oznaczałoby całkowity bezruch). Najbardziej utalentowani w tym aspekcie naukowcy zdołali uzyskać w laboratoriach temperaturę rzędu nanokelwinów (jeden kelwin podzielić przez miliard). Dlatego właśnie we wzorze na początku należało przedstawić temperaturę w Kelwinach, a nie stopniach Celsjusza, bowiem skala Celsjusza 'zeruje' się dla temperatury krzepnięcia wody w warunkach normalnych, w której cząstki posiadają jeszcze wysoką energię.

I na koniec cały proces ochładzania jeszcze raz.
Na koniec pójdźmy w drugą stronę - co się stanie, jeśli gaz będzie nadal zwiększać temperaturę? Otóż w pewnej chwili dojdziemy to takiego momentu, w którym atomy przestaną trzymać się w kupie. Będą poruszać się tak szybko, że elektrony powypadają im z orbitali i w ten sposób otrzymamy plazmę - luźną chmurę luźno latających elektronów (no i siłą rzeczy, jąder atomowych).
Lecz czy to oznacza koniec? Nie, możemy plazmę ogrzewać nadal. I wówczas nawet jądra przestaną trzymać się kupy. A potem składniki tego jądra, bariony (protony i neutrony) rozpadną się na kwarki, które nie istnieją w naturze właśnie ze względu na nietrwałość w niskich (niskich oznacza INNYCH NIŻ NIEWYOBRAŻALNIE WYSOKIE) temperaturach.
Ogólnie rzecz ujmując, granica istnieje tylko z jednej strony - nie da się osiągnąć zera absolutnego, jednakże co do wysokości temperatur limitu nie ma. Być może i kwarki w końcu rozpadają się na coś innego, ale o tym dowiemy się za wiele lat, bowiem zaobserwowanie nawet ich na dzień dzisiejszy jest bardzo trudne. Tym się tak w ogóle zajmują Zderzacze Hadronów takie jak LHC.
Na dzisiaj to wszystko. Następnym razem napiszę może nieco o warstwach LB (tak jak obiecywałem), albo o niczym, czyli próżni, którą ten przedmiot także się zajmuje.



6 komentarzy
Rekomendowane komentarze